Hidrosfera: A água do nosso planeta
A hidrosfera é uma das camadas mais importantes do nosso planeta, composta por toda a água presente na Terra. Isso inclui oceanos, mares, rios, lagos, geleiras, lençóis subterrâneos e até mesmo a água presente na atmosfera na forma de vapor. A água é essencial para a vida na Terra, desempenhando papéis fundamentais nos processos climáticos, na formação e modelagem do relevo, na regulação da temperatura e na sustentação dos ecossistemas. Nesta introdução, exploraremos a importância da hidrosfera, seus componentes e seu papel vital para a manutenção da vida no nosso planeta.
Como nós já vimos anteriormente o nosso planeta é estruturado em camadas. 71% da Crosta é composta por água e os 29% é a crosta terrestre.
A água do planeta pode ser encontrada em Nitrogênio, Oxigênio, Gás Carbônico, Argônio e vapor da água.
97% da água no planeta é salgada, e somente 3% é água doce:
. 2,2% está no estado sólido em formas de grandes massas de gelo. Nesta forma tem poucos sais minerais e pode ser encontrada em Polos, Permafrost, cume das montanhas, geleiras.
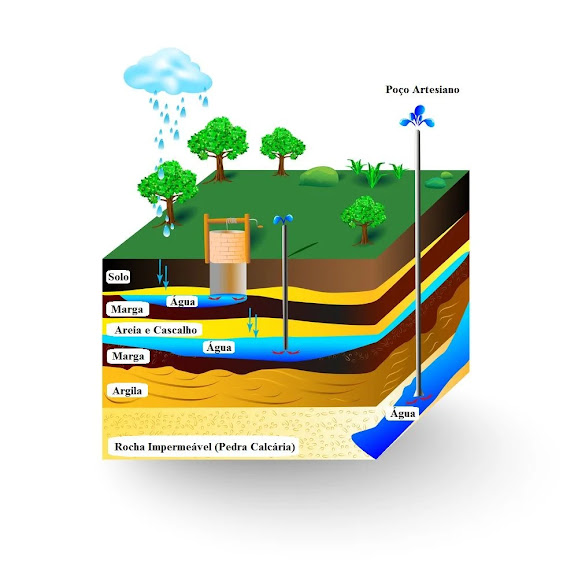
. 0,6% está no estado líquido, em baixo da camada superficial da Terra, elas podem ser encontradas em Aquíferos, Lençóis Freáticos, é de difícil acesso, pois para acha-la temos que cavar um buraco razoavelmente fundo.
. 0,1% está em estado gasoso, pois é encontrado na atmosfera do planeta.
. 0,1% desse total está acessível para consumo humano, presente em rios, lagos e reservatórios. É essencial conservar e preservar essa pequena porcentagem de água potável, pois a maior parte da água na Terra não é adequada para consumo direto devido à sua salinidade ou estado gasoso na atmosfera
Formula da Água
Molécula da Água
Dois átomos de hidrogênio e um de oxigênio compõem a molécula da água.
Embora haja uma ligação química entre um átomo de hidrogênio e um de oxigênio, os elétrons são atraídos de forma mais eficaz pelo oxigênio, resultando em uma distribuição assimétrica de cargas na molécula.
Consequentemente, a molécula de água possui uma região positiva, representada pelos hidrogênios, e uma região negativa, representada pelo oxigênio, resultando em uma molécula polar ou dipolar. Essa estrutura confere à água diversas propriedades importantes para os seres vivos e a capacidade de dissolver uma variedade de substâncias orgânicas e inorgânicas.
A Fórmula plana da água água é representada assim:
H-O-H
A fórmula da água, popularizada por Lewis, pode ser representada assim:
O
/ \
H H
Esta ligação entre o Hidrogênio e o Oxigênio é chamada de ligação Covalente; a molécula de água tem que estar em condições extremas, para que essa ligação seja rompida.
A água no seu estado líquido é composta por suas moléculas, como visto antes representada na fórmula de H2O, para unir diversas dessas moléculas é necessário que haja uma outra ligação, na qual, a mesma é chamada de Ligação Intermolecular( Ligação de Hidrogênio). E é justamente esta ligação que mantém a água em seu estado líquido.
Curiosidade: O universo é composto aproximadamente de 98 à 99% de Hidrogênio.
Tensão Superficial da Água
A água exibe uma variedade de propriedades notáveis, uma das quais é sua tensão superficial.
Essa característica decorre das ligações de hidrogênio entre as moléculas de água, onde os átomos de hidrogênio de uma molécula são atraídos pelos átomos de oxigênio de moléculas vizinhas.
A diferenciação de forças de atração entre as moléculas na superfície da água e aquelas abaixo dela é a causa dessa tensão. Enquanto as moléculas abaixo da superfície são atraídas igualmente em todas as direções, as moléculas da superfície têm uma atração restrita às moléculas ao lado e abaixo delas.
Essa discrepância de atração cria uma força na superfície da água, resultando na formação de uma fina película elástica, conhecida como tensão superficial. Cuidadosamente, seres vivos conseguem até se locomover em cima da água por conta dessa tensão superficial.
Resumo:
Trata-se da formação de uma fina película na superfície de um líquido devido às diferentes interações entre suas moléculas. Esse fenômeno é mais pronunciado em líquidos com fortes forças intermoleculares, como a água.
As moléculas no interior de um líquido sofrem atrações por todas as direções, enquanto na superfície, essas forças estão direcionadas para baixo e para os lados. Isso cria uma película elástica devido à desigualdade de atrações.
A água, uma molécula polar, forma ligações de hidrogênio devido aos polos positivos dos átomos de hidrogênio e ao polo negativo do átomo de oxigênio. Essas interações contribuem para a alta tensão superficial da água, medida em unidades como dina/centímetro ou newton/metro. Comparativamente, o mercúrio possui uma tensão superficial cerca de 7 vezes maior que a água.
Além disso, a tensão superficial da água desempenha um papel crucial em diversos fenômenos naturais, como a capilaridade, em que a água sobe em tubos finos contra a gravidade, e a formação de gotas de chuva, que mantêm sua forma esférica devido à tensão superficial. Essa propriedade também é explorada em muitas aplicações práticas, como na fabricação de detergentes e na produção de tintas e vernizes.
Os estados da Água
A água tem três estados, que são:
. Sólido \
. Líquido } São chamados também de Estados de agregação da Matéria
. Gasoso /
A água pode existir em três estados diferentes: sólido, líquido e gasoso. No estado sólido, como gelo nos polos e icebergs, as moléculas estão próximas e a água tem forma e volume definidos. No estado líquido, como em rios e oceanos, as moléculas estão mais afastadas e adotam a forma do recipiente. No estado gasoso, na atmosfera, as moléculas estão muito distantes e não têm forma nem volume definidos. Isto só é possível, pois as suas moléculas são únicas, com propriedades que permite a água de estar nos três estados.
A ligação de hidrogênio, uma força intermolecular, é uma atração entre um átomo de hidrogênio parcialmente positivo e um átomo de oxigênio, flúor ou nitrogênio parcialmente negativo. A diminuição do tamanho dessa ligação ocorre quando as moléculas de água se aproximam e formam essa ligação em temperaturas mais baixas, como na formação de gelo.
Essa diminuição no comprimento das ligações de hidrogênio faz com que as moléculas de água se organizem em uma estrutura cristalina mais espaçosa, o que resulta na expansão do volume e, consequentemente, no aumento da densidade. Isso significa que o gelo é menos denso do que a água líquida, o que é uma propriedade incomum para a maioria das substâncias.
Essa peculiaridade é fundamental para a vida aquática, pois permite que o gelo flutue na superfície da água em vez de afundar. Isso impede que os corpos de água congelem de baixo para cima, garantindo que os organismos aquáticos possam sobreviver sob a camada de gelo durante os meses mais frios.
Essa ligação de hidrogênio é inexistente na sua forma gasosa, pois como está ligação intermolecular é mais frágil, com a energia solar e cinética as moléculas se rompem assim tendo um espaço maior entre elas.
Curiosidade: A densidade calcula-se assim massa dividido pelo volume do objeto, ou ser.
Processo de transformação
dos estados da água:
A Vaporização pode ocorrer de forma rápida ou lenta:
Vaporização Lenta: Evaporação
Vaporização Rápida: Calefação e Ebulição
Evaporação:
A Evaporação é um processo da água, que é quando passa do estado líquido para o estado gasoso, um exemplo de evaporação é quando colocamos roupa para secar no varal. A ligação de hidrogênio absorvida, junto da água no estado líquido, pela roupa é rompida por conta da energia.
Calefação:
A calefação é um tipo de vaporização que ocorre quando um líquido é lançado em uma superfície que apresenta temperatura maior que a do seu ponto de ebulição. Nesta situação, o líquido rapidamente passará para o estado gasoso. Um exemplo de calefação é quando jogamos algumas gotas de água em uma chapa muito aquecida.(Toda Matéria)
Ebulição:
No caso da água é conhecido como "fervura". Ebulição é quando uma substância está em seu estado líquido e passa para o estado gasoso a partir do aumento de temperatura constante. Um exemplo é quando colocamos a água em um "bully" e abaixo colocamos energia, o fogo.
Ebulição da água através da recepção de energia feita por uma chaleira.
Ponto de Ebulição é quando o estado líquido de alguma substância está passando para o gasoso.
Ponto de Fusão é quando o estado sólido de alguma substância está passando pro estado líquido.
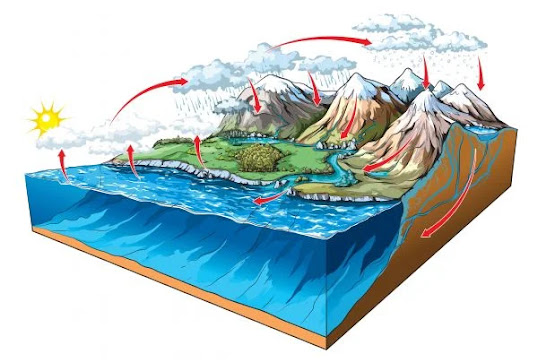
Ciclo d'agua
Os raios solares, Fótons, fazem a água dos oceanos, rios e lagos evaporarem, o vapor da água se condensa, formando nuvens, porém a condensação pode ocorrer juntamente da respiração de animais e transpiração de plantas e animais. Essas nuvens se carregam de gotículas de água na atmosfera, fazendo assim a precipitação de gotas de água, a chuva. Após isso uma parte desta água infiltra no solo, juntando-se a lençóis freáticos e aquíferos, o resto precipita em cima de rios, lagos e oceanos, reabastecendo-lhes.
Curiosidade: Podemos observar a condensação do ar, a partir do nosso bocejo.
Quando bocejamos em uma região fria percebemos que saiu uma névoa de ar na nossa boca, essa névoa é ar junto de gotículas de água que ao ser exposta a temperaturas frias se condensa.
Referencias Bibliográficas:
















Comentários
Postar um comentário